Nacional
Vacina de Oxford no Brasil depende da liberação de R$ 1,9 bi em análise pelo governo
Medida provisória será editada pelo Ministério da Economia. Vacina em teste pelo Butantan com Sinovac não foi considerada na elaboração do plano de imunização.
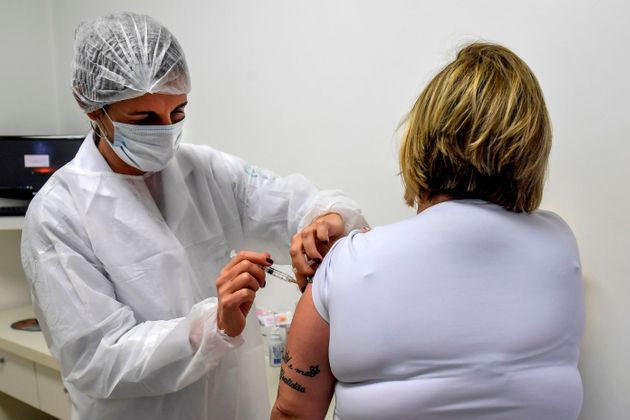
O governo federal vai publicar uma medida provisória (MP) para viabilizar o acesso a 100 milhões de doses da vacinacontra covid-19 desenvolvida pela Universidade de Oxford. Nesta segunda-feira (3), integrantes do Ministério da Saúde informaram que o texto está em estudo no Ministério da Economia, liderado por Paulo Guedes. No momento, o plano de imunização não inclui outras iniciativas, como a desenvolvida pela farmacêutica chinesa Sinovac Biotech, em parceria com o Instituto Butantan, de São Paulo.
A MP prevê a liberação de crédito orçamentário extraordinário no valor de R$1,9 bilhão, sendoR$ 1,3 bilhão para despesas correntes referentes a pagamentos à AstraZeneca, farmacêutica detentora dos direitos de comercialização da vacina de Oxford, previstos em contrato.
Outros R$ 522,1 milhões são para despesas correntes necessárias ao processamento final da vacina em Bio-Manguinhos, unidade da Fiocruz (Fundação Oswaldo Cruz) no Rio de Janeiro produtora de imunobiológicos. Mais R$ 95,6 milhões serão destinados a investimentos necessários para absorção da tecnologia de produção pela Fiocruz.
Medidas provisórias passam a produzir efeitos jurídicos desde sua publicação pelo Executivo, mas precisam do aval do Congresso Nacional para se converter definitivamente em lei ordinária.
Na última sexta-feira (31), foi assinado um Memorando de Entendimento (MoU) por integrantes da Fiocruz e da AstraZeneca. O documento “estabelece termos e condições gerais que norteiam o processo de negociação e estabelecimento das diretrizes para elaboração do contrato de encomenda tecnológica e do contrato de transferência de tecnologia da produção da vacina”, de acordo com o Ministério da Saúde.
Segundo o secretário de Ciência, Tecnologia e Insumos Estratégicos (SCTIE) do ministério, Hélio Angotti Neto, a previsão é que o acordo de fato seja assinado em 14 de agosto. A parceria com a farmacêutica britânica foi anunciada pelo governo em 27 de junho.
A negociação prevê o acesso a 30 milhões de doses entre dezembro deste ano e janeiro de 2021 e outras 70 milhões ao longo dos dois primeiros trimestres do próximo ano. O acordo inclui tanto a compra do ingrediente farmacêutico ativo (IFA) quanto a transferência de tecnologia para que etapas da produção possam ser feitas em território nacional.
A expectativa mais otimista é que em novembro sejam publicados resultados preliminares do teste clínico da vacina desenvolvida pela Universidade de Oxford. O Brasil faz parte dos países em que o produto está sendo testado em humanos, na chamada fase 3. O ensaio clínico com 5.000 voluntários está sendo feito nas cidades de São Paulo, Rio de Janeiro e Salvador (BA), por meio de parcerias com a Unifesp (Universidade Federal de São Paulo) e com o Instituto D’Or.
O modelo desenvolvido pela Universidade de Oxford usa uma versão enfraquecida do vírus, que causa o resfriado comum (adenovírus), contendo o material genético da proteína spike do Sars-CoV-2.
A vacina não causou efeitos adversos graves e provocou respostas imunes de anticorpos e das células T, outras células de defesa do corpo humano, de acordo com os dados publicados na Lancet. Os dados se referem à reação de 1.077 adultos no Reino Unido nas fases iniciais. A eficácia só poderá ser comprovada na fase 3, ainda em curso. É possível que sejam necessárias duas doses.
A vacina do Butantan com a Sinovac
Outra vacina contra covid-19 que também está na fase de testes clínicos no Brasil, com 9 mil voluntários, é desenvolvida pela farmacêutica chinesa Sinovac Biotech, em parceria com o Instituto Butantan. A previsão do governo de São Paulo é de acesso a 120 milhões de doses, caso ela se prove segura e eficaz. A técnica é de inativação do novo coronavírus, diferente da escolhida pelos pesquisadores britânicos.
Embora o ministro interino da Saúde, Eduardo Pazuello, tenha dito que ela pode ser incorporada ao SUS, integrantes da pasta afirmaram nesta segunda que o plano de imunização considera apenas a iniciativa de Oxford até agora.
Cabe ao Ministério da Saúde estabelecer como será a distribuição dentro do Programa Nacional de Imunizações (PNI). É nessa etapa que são definidos, por exemplo, grupos prioritários, como profissionais de saúde e idosos, em um esquema semelhante ao que ocorre hoje com o calendário da vacina para gripe.
“O quantitativo com o qual temos trabalhado é de 100 milhões de doses. Claro que tudo isso vai depender muito do desempenho da fase 3 dessa vacina e, com base nesse desempenho no cronograma de entrega conforme todo o estudo logístico que será realizado pelo Ministério da Saúde, poderemos entregar à sociedade um planejamento adequado de como essas doses serão dispensadas, como será um esquema de vacinação”, disse Hélio Angotti Neto.
De acordo com o secretário, outras propostas, especialmente aquelas na fase 3, têm sido acompanhadas pela pasta. Sobre a pesquisa do Butantan, Angotti afirmou que “foi uma iniciativa do estado de São Paulo, então também aguardamos resultados, acompanhamos os resultados de pesquisa e assim que tivermos mais informações creio que poderemos compartilhar”.
O secretário-executivo do ministério, Elcio Franco, por sua vez, afirmou que há negociações iniciais caso o plano da vacina de Oxford não ocorra como esperado. “Nós buscamos soluções alternativas por se tratar de um encomenda tecnológica e haver um grau de incerteza. Embora nos pareça remota, existe a possibilidade de um atraso no desenvolvimento da vacina”, ponderou.
Quem irá receber a vacina?
Em junho, a pasta anunciou que as 100 milhões de doses irão contemplar a cobertura vacinal dos seguintes grupos: idosos, pessoas com comorbidades, profissionais de saúde, professores, indígenas, pessoas em privação de liberdade, profissionais de segurança pública, de salvamento e motoristas de transporte coletivo. O esquema de vacinação deve ser escalonado, de maneira semelhante ao que ocorre com o calendário de imunização para gripe.
O secretário-executivo do ministério afirmou que “até pelo grande desconhecimento dessa doença em todo o mundo, pode haver uma variação do publico alvo ate iniciarmos a vacinação”.
Já o titular da SCTIE afirmou que “serão feitas diversas análises epidemiológicas para ter o melhor plano de distribuição dessa vacina possível”.
Quanto à possível falta de insumos, Angotti afirmou que o ministério está no processo de aquisição de 110 milhões de seringas e agulhas e tem “movido vários esforços para aumento da cobertura vacinal”.
O registro da vacina
Segundo o HuffPost apurou, a vacina contra covid-19 pode ser incorporada ao SUS mesmo que algumas etapas do ensaio clínico ainda estejam em curso. Isso porque é possível que resultados preliminares favoráveis em outros países, como o Reino Unido, permitam que o processo seja mais rápido. Normalmente, uma vacina levaria 18 meses para ser aprovada.
Em março, a Anvisa (Agência de Vigilância Sanitária) publicou uma resolução estabelecendo normas especiais para o registro de medicamentos, produtos biológicos e produtos para diagnóstico in vitro para prevenção ou tratamento da covid-19. O prazo para análise do registro passou para 30 dias após a formalização do pedido. O procedimento normal pode levar até 1 ano.
Os critérios para concessão de registro podem ser flexibilizados no caso de eventuais vacinas, desde que seja inequívoca sua eficácia e segurança. Agências regulatórias em outros países têm atuado dessa forma com a incorporação de tecnologias para enfrentamento da pandemia nos sistemas de saúde. Em um cenário otimista, a vacina poderia estar disponível nos postos de saúde ainda no início de 2021.
Pela legislação brasileira, para uma nova tecnologia ser incorporada ao SUS, é necessário ter registro aprovado pela Anvisa e aval da Conitec (Comissão Nacional de Incorporação de Tecnologias no SUS). Para ambas as etapas, é necessário que haja comprovação científica do uso daquele produto.