Saúde
O verme que ajudou a explicar o desenvolvimento do corpo humano
Você já ouviu falar do Caenorhabditis elegans? É um ser excepcional, uma celebridade em laboratórios, que foi indispensável para várias descobertas e contribuiu para o sucesso de seis ganhadores do prêmio Nobel

Seu nome é uma mistura das palavras gregas (caeno, que significa “novo” ou “recente”, e rhabditis, algo como “bastão”) e em latim (elegans, que quer dizer elegante). Mas, para abreviar, é chamado de C. elegans.
Em seu ambiente natural, esse minúsculo verme vive no espaço entre os grãos de terra, e foi no solo da Argélia que o zoólogo francês Émile Maupas o encontrou — ele foi o primeiro a isolá-lo, descrevê-lo e selecioná-lo como sua espécie de referência em 1900.
Vários cientistas seguiram seus passos, particularmente o biólogo francês Victor Nigon e a bióloga americana Ellsworth Dougherty.
Mas foi graças à busca do biólogo sul-africano Sydney Brenner por um novo modelo animal que pudesse ajudá-lo a explorar os mistérios do desenvolvimento e do comportamento humano que o verme ficou famoso, em 1963.
“Precisávamos de um organismo com o qual pudéssemos estudar genética de maneira adequada”, afirmou Brenner na época.
“Como era preciso ver onde uma célula terminava e outra começava, tinha que ser com o microscópio eletrônico, então, eu precisava de um organismo pequeno que caberia na janela desses microscópios. Finalmente, decidi por esses pequenos vermes nematódeos, C. Elegans, e comecei a trabalhar com eles. “
“Sydney Brenner é um deus na comunidade de vermes por ter escolhido este organismo modelo”, diz Gordon Lithgow, vice-presidente do Instituto Buck de Pesquisa sobre o Envelhecimento, nos Estados Unidos.
“O que ele realmente fez foi tomar uma decisão muito sábia que permite estudar biologia realmente complexa em um sistema simples. E essa foi a verdadeira genialidade. Trata-se de uma biologia básica, sem dúvida, mas é incrível como essa biologia básica agora se traduziu para os humanos e a compreensão das doenças.”
As aparências não enganam
Na verdade, a aparência do C. elegans é um dos seus muitos atrativos para se tornar um modelo.
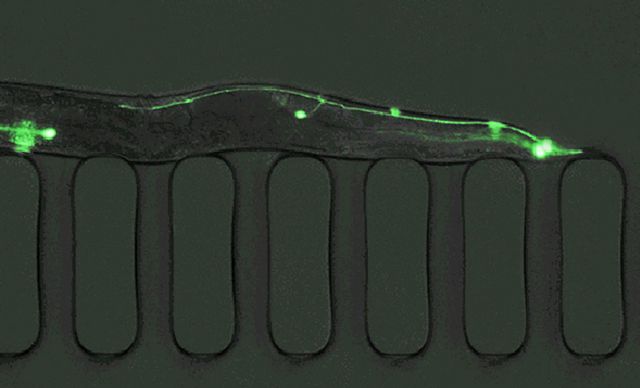
“A grande vantagem é o fato de ser transparente. Dá para ver através de sua pele!”, exclama Lithgow.
“Você pode realmente ver células e processos biológicos acontecendo, apenas olhando por um microscópio.”
“Além disso, é pequeno. Tem menos de um milímetro de tamanho, então você pode cultivar centenas de milhares desses vermes em laboratório, e isso é muito importante se você estiver buscando um gene raro ou algo parecido.”
“A genialidade de Sydney Brenner foi perceber que, embora tenhamos centenas de bilhões de células em nosso cérebro, o verme tem apenas 302 neurônios, e você pode observá-los através de sua pele transparente e estudá-los.”
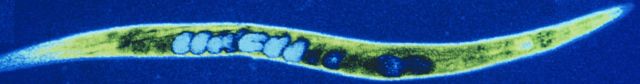
Por que é tão ideal?
– O verme nematoide C. elegans é muito mais simples do que os humanos — não tem, por exemplo, ossos, coração ou sistema circulatório — mas compartilha muitos genes e vias moleculares conosco;
– Além disso, muitos dos sinais moleculares que controlam seu desenvolvimento também são encontrados em organismos mais complexos, como os humanos;
– Muitos dos genes no genoma do C. elegans têm equivalentes funcionais em humanos, fazendo dele um modelo extremamente útil para explorar doenças humanas;
– Formas de C. elegans nas quais genes específicos são alterados podem ser produzidas com muita facilidade para estudar de perto a função dos genes;
– Essas mutações fornecem modelos para muitas doenças humanas, incluindo distúrbios neurológicos, doenças cardíacas congênitas e doenças renais;
– Podem ser usados para testar milhares de drogas em potencial para doenças importantes.


“O verme é espetácular como organismo modelo por uma série de razões”, diz Bob Waterston, professor de Ciências do Genoma da Universidade de Washington, nos Estados Unidos.
“Tem menos de 1 mil células na idade adulta e sabemos quais são todas essas células e o que fazem. É pequeno, então, é possível obter uma grande quantidade delas, e isso é importante para a genética, porque permite observar vários eventos raros. É difícil fazer a genética de um rinoceronte, como Sydney costumava dizer!”, acrescenta Waterson, que ingressou no laboratório de Sydney Brenner em Cambridge, no Reino Unido, no início dos anos 1980 e é mais conhecido por seu trabalho no Projeto Genoma Humano.
Mas, como preparação para essa tarefa gigantesca, ele fez parte da pequena equipe que mapeou o genoma do C. elegans, o primeiro animal a ter seu genoma totalmente sequenciado.
Dúvidas infundadas
“Na época, havia muito ceticismo”, ele lembra.
“Primeiro, se perguntavam se valia a pena sequenciar um genoma inteiro, ou se deveriam fazer algo mais barato… ou nem sequer fazer nada, simplesmente estudar genes individuais.”
“O segundo problema era que ninguém sabia como fazer isso. O que fizemos foi realmente um experimento para ver se as tecnologias da época poderiam ser adaptadas, refinadas o suficiente para sequenciar um genoma do tamanho do C. elegans. Se pudéssemos fazer isso com algo do tamanho de um cromossomo humano médio, provavelmente seria possível estender para todo o genoma humano.”
Isso, como sabemos agora, acabou se mostrando possível.

E, apesar das dúvidas iniciais sobre se a missão valia a pena ou não, ter o mapa completo do genoma do verme acabou sendo mais útil do que qualquer um esperava, como diz Gordon Lithgow.
“Acontece que o verme e os humanos são muito semelhantes em sua biologia básica.”
“Quando o genoma do C. elegans foi sequenciado, descobrimos que algo como 2/3 dos genes envolvidos nas doenças humanas estavam no verme. Isso significava que era possível estudar essa biologia que é de vital importância para as doenças humanas nessa pequena criatura.”
Mais vida
Em 1988, cientistas que trabalhavam com vermes mutantes nos Estados Unidos descobriram por acaso uma mutação em um único gene que aumentava a vida útil do C. elegans em até 65%.
Cinco anos depois, o verme ganhou as manchetes quando encontraram outra mutação de um único gene que podia prolongar sua vida em até dez vezes. Além disso, os vermes permaneceram saudáveis até o fim.
“De certa forma, mudou a maneira como as pessoas pensam sobre o envelhecimento”, diz Lithgow.
“Achávamos que a vida útil era como uma quantidade fixa, mas o que o verme nos mostrou foi que a vida útil é plástica, que realmente podia ser alterada em uma dimensão dez vezes maior… É incrível!”

“Resulta que a nível molecular, a nível celular, os processos que impulsionam a vida útil de 20 dias do C. elegans são muito semelhantes aos processos que acreditamos que impulsionem o envelhecimento em seres humanos. E o mais importante é que não se trata apenas de envelhecer; trata-se das doenças do envelhecimento”, enfatiza o especialista.
“Acreditamos que os mecanismos que estamos estudando no verme são os impulsionadores, até mesmo as causas, de doenças como Alzheimer, câncer, osteoporose, osteoartrite, Parkinson, etc.”
“Então: o verme mudou a forma como as pessoas pensavam sobre o envelhecimento e a expectativa de vida. E depois, devido à conexão com as doenças, o verme mudou a maneira como pensamos sobre as doenças crônicas humanas.”
O presente da natureza
Ninguém ficou mais surpreso do que Sydney Brenner ao ver o quanto estava sendo revelado ao estudar o C. elegans.
“Foi muito surpreendente, porque na época era um campo completamente novo, e acho que decolou; agora é toda uma uma indústria”, declarou, na época.
Vários prêmios Nobel foram provenientes do estudo do verme, incluindo o que Brenner recebeu.
“O título da minha palestra é ‘o presente da natureza para a ciência’ (…), e será sobre como a diversidade biológica pode ser — e tem sido — usada para o avanço da pesquisa científica. Gosto de pensar que o quarto vencedor do prêmio Nobel este ano é o Caenorhabditis elegans e acho que ele merece a maior parte da homenagem, embora é claro que ele não vai compartilhar a recompensa em dinheiro! (Risos)”, afirmou Brenner em sua palestra no Nobel em 2002.
A equipe da BBC News Brasil lê para você algumas de suas melhores reportagens
Episódios
Fim do Podcast
Esse pequeno “presente da natureza para a ciência” provou ser inestimável… e o que rendeu a Sydney Brenner e dois colegas o Prêmio Nobel foi a descoberta do programa de suicídio celular.
O suicídio celular é o processo que esculpe nossos corpos no útero, removendo a teia de pele entre os dedos das mãos e dos pés, esvaziando os tubos, moldando nossos órgãos e construindo nosso cérebro.
“No verme, as células se dividem e produzem mais células”, explica Bob Waterston.
“Mas, às vezes, você não precisa de uma das células-filhas que são fabricadas. E, surpreendentemente, a biologia inventou um sistema basicamente para o suicídio celular. A célula é programada para decidir que não é necessária e ativa esse programa que a mata.”
“Isso se mostrou ser muito importante em toda a biologia. No câncer, é incrivelmente importante: se você não tiver controle adequado da morte celular, se não tiver esse programa de suicídio ativado, isso pode levar a certos tipos de câncer.”
Da terra ao céu
E não para por aí: o pequeno verme tem sido usado para testar os limites da biologia em ambientes mais extremos.
“C. elegans esteve no espaço”, diz Lithgow entusiasmado.
“Foi parte de um dos experimentos biológicos inicialmente realizados em um ônibus espacial. E mais: foi possivelmente o primeiro organismo terrestre a se reproduzir no espaço. São hermafroditas, então se autofecundam, e esses vermes enviados ao espaço foram capazes de se reproduzir, o que foi muito emocionante. “
Mas também foram parte de uma tragédia.

Em 2003, para o horror daqueles que controlavam a missão e de milhões de pessoas que ligaram suas televisões para assistir ao retorno do ônibus espacial, o Columbia se desintegrou ao entrar na atmosfera da Terra.
“Algum tempo depois do desastre, os vermes foram recuperados no recipiente em que o experimento estava sendo realizado e estavam vivos!”
“É incrível que eles estivessem ali, eles passaram por isso e voltaram à Terra”, conta Lithgow.
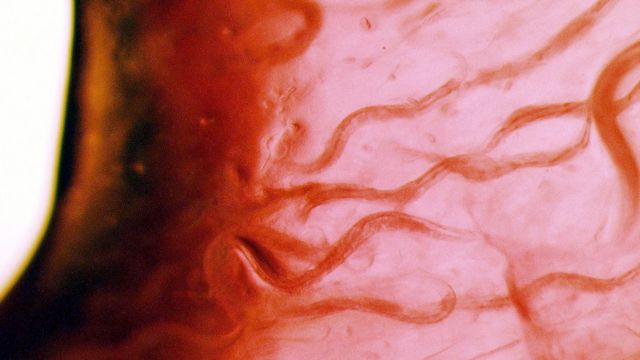
“O C. elegans deu uma contribuição após a outra ao nosso conhecimento”, diz Waterston.
E tudo parece indicar que continuará contribuindo.
Hoje, também são usados para testar todos os tipos de drogas, incluindo aquelas que os cientistas esperam que possam retardar e melhorar os processos de envelhecimento.